バイオシミラー(英:Biosimilar)とは、バイオ医薬品(分子標的薬剤を含むグループ)の特許切れ後に発売された、同等の効果を保障された医薬品群のことである。別名、バイオ後続品ともいう。
位置づけ
バイオシミラー・後発医薬品・分子標的薬剤・先行バイオ品。ごちゃごちゃになりがちなので、以下にまとめる。
| 名称 | 低分子医薬品 | バイオ医薬品 |
| 含むもの | 既存の薬ほとんど | 分子標的薬剤・インスリン製剤 ・ホルモン剤など |
| 構造の違い | 炭素結合がメイン 分子量500以下 | タンパク質構造がメイン 分子量10000以上 |
| 先発品 | 先発低分子薬 | バイオ先行品 |
| 特許切れ後 (後続品) | 後発医薬品 | バイオシミラー (別名:バイオ後続品) |
図を見て気が付くと思うが、バイオシミラー=全てが分子標的薬剤の後発品、というわけではない。また「低分子医薬品」以外が全て「分子標的薬剤」というわけではない。
またバイオ医薬品=全てがこの10数年で登場したわけではない。例えば(バイオ医薬品である)インスリンは1920年代に発売されている。
バイオシミラーの有効性
バイオシミラーは「後発品」ということで、安かろう悪かろうのイメージをもたれる事が多い。それは低分子医薬品の特許切れ「後発医薬品」が、安かろう悪かろうだったからである。
実際に先発低分子薬➡後発医薬品に変更し、添加物の違いで痒みが出た等の不具合が多かった。不具合の理由は後発医薬品に課される試験の数が少なく、早い話が「いい加減でも発売できた」からである。
しかし比較すると、後発医薬品とバイオシミラーとで、テストした試験の数などは全く違い、厳しさが違う。
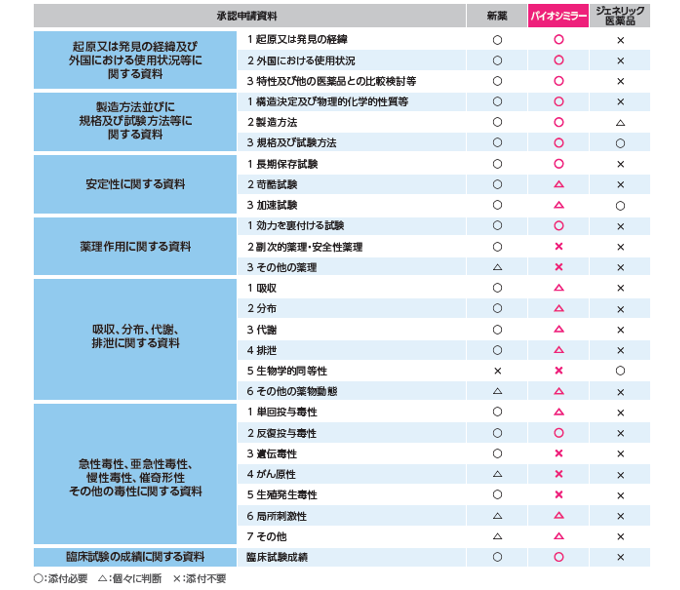
この厳しい試験の為、バイオシミラーは先発の70%程度の薬価となっている(比較として、後発医薬品は先発の50%程度の薬価である)。
バイオシミラーの売上推移
近年、バイオシミラー市場の急拡大が知られている。参考データをこちらに載せる。
| 全医薬品 | バイオシミラー | |
| 2016 | 104300億円 | 128億円 |
| 2017 | 105200億円 | 144億円 |
| 2018 | 103300億円 | 215億円 |
| 2019 | 106300億円 | 350億円(推計) |
| 2020 | ー | 450億円(推計) |
| 2021 | ー | 534億円(推計) |
近年の急拡大が目立っている。
急拡大の理由として、バイオシミラーの先発品である先行バイオ品は、10年ほど前より急増し使われてきているからである。その先行バイオ品の特許は10年前後で切れてくる為、いまバイオシミラーの急増に繋がっている。
また急拡大のもう一つの理由として、そもそもバイオシミラーという考え方が世界的に存在しなかった(日本では平成21年にようやく定義された。出典1.参照)。例えばインスリン製剤の特許などとっくにきれて久しいのだが、バイオシミラーという考え方が無かったため、ずっと先発品のみだった。そのインスリン会社であるフランス・サノフィ社は、インスリン製剤(ランタス皮下注®)の売上が保障され続けていた為、世界大手企業になることができた。(ランタス®は2018年度の世界医薬品売上で2位)
バイオシミラーのメーカー
以下のメーカーが、ある程度バイオシミラーを開発・発売している。
世界
| ファイザー | PFE | 米国 |
| メルク | MRK | 米国 |
| サノフィ | SNY | フランス |
| テバ | イスラエル | |
| セルトリオン | 韓国 |
ファイザーなどは元々先発医薬品メーカーであるが、近年新薬の開発がうまくいかず売り上げが伸び悩んでいた。分子標的薬剤には弱かったからである。その為近年、バイオシミラー路線に方針転換している。
サノフィは元々バイオ医薬品(その中でもインスリン)を作れる会社で、ノウハウ流用ができる為バイオシミラーも多発している。
日本
| 日本化薬 | 日本 | |
| 持田製薬 | 日本 | |
| 日医工 | 日本 | |
| 富士製薬 | 日本 |
沢井・日本ジェネリック・東和・田辺三菱といったいわゆる「後発医薬品の大手」が、ここには入らない。これは後発医薬品(低分子薬の後続品)と、バイオシミラー(バイオ医薬品の後続品)とで、作るノウハウが全く違うからである。
持田製薬は元々バイオ医薬品に強い会社で、すでにノウハウを所持していたためバイオシミラーにも強い。日本化薬は世界売上ランキングに載る「トラスツズマブ」「ベバシズマブ」「インフリキシマブ」の全てで商品化しており、その品質は現場で認められてきている。日医工は元々「後発医薬品の大手」だったが、近年バイオシミラー市場にも進出してきている。
バイオシミラーが株価に与える影響
バイオシミラーは株価にたいして、先行バイオ品(分子標的薬剤の先発品)ほど大きな寄与はないとされる。その理由は、(先行バイオ品にはほぼ無い)他社競合が起こるからである。
他社競合の例として、レミケード(先行バイオ品)のバイオシミラーについて考える。
●インフリキシマブBS「NK」
●インフリキシマブBS「日医工」
●インフリキシマブBS「あゆみ」
●インフリキシマブBS「トーワ」
特許切れ前は、レミケード1剤だけだったので高くても買うしかなかった。しかし特許切れにより、バイオシミラー4社が競合し、値引き合戦となるからである。
出典
1.バイオ後続品の承認申請について(平成21年3月4日、厚労省医薬食品長の通知より)
2.バイオ後続品の品質・安全性・有効性確保のための指針(平成21年3月4日、厚労省医薬食品長の通知より)
関連リンク
ヘルスケア・セクター

コメント